龙胆苦苷的体外稳定性
发布时间:2016-07-16 浏览次数:3343
龙胆苦苷的体外稳定性
陈国锋、高东雁、张文鑫、王建新
目的:研究龙胆苦苷(GTP)在体外生物样品中的稳定性。
方法:将龙胆苦苷溶解在不同pH的磷酸盐缓冲液、pH1.2的盐酸溶液及大鼠胃肠黏膜匀浆、胃肠道内容物、肝组织匀浆和血浆中,37℃恒温水浴,孵育-定时间后取样,高效液相色谱法测定龙胆苦苷的浓度,考察其在不同pH缓冲液和生物样品中的稳定性。
结果:37℃孵育48h后,龙胆苦苷在pH1.2的盐酸溶液、pH6.8.7.4和8.0的磷酸盐缓冲液中的降解百分率分别为2.6%、7.9%、20.2%和34.4%。龙胆苦苷在胃内容物、胃黏膜、小肠内容物、肠黏膜、肝组织匀浆中稳定,而在大肠内容物中12h降解79.8%,血浆中24h降解46.9%。
结论:GTP在偏酸性环境中较稳定,随碱性增加稳定性显著降低;GTP在胃、小肠、肝脏中稳定,而在血液和大肠中易降解。
关键词:龙胆苦苷;生物样品;稳定性
龙胆为龙胆科植物条叶龙胆Gentiana manshurica Kitag.、龙胆Gentiana scabra Bge.、三花龙胆Gentiana triflorapall.或坚龙胆Gentiana regescen Franeh.的干燥根及根茎,为中医常用的清肝胆实火,除下焦湿热的要药。裂环环烯醚萜苷类为龙胆中的主要活性部位,包括龙胆苦苷(Gentiopierin,GTP)、当药苦苷(Swertiamarian)、当药苷(Sweroside)、马钱子苷酸(Loganicacid)等。其中龙胆苦苷为龙胆中的主要活性成分,具有保肝、利胆、健胃、抗炎、抗菌等活性,是评价龙胆质量的主要指标成分。研究发现,小鼠GTP灌胃后,虽然吸收迅速,但生物利用度较低。
杨肖锋等对大鼠GTP灌胃后的体内代谢进行了研究,发现血清中第2天检测到龙胆碱和龙胆醛,肠内菌体外培养液中GTP含量的下降和龙胆碱与龙胆醛含量的上升呈同步变化,提示龙胆碱和龙胆醛可能是GTP体内代谢的重要生物活性产物。,影响药物口服吸收生物利用度的因素较多,如药物的解离度、脂溶性、溶出速度、膜通透性等,其中药物在胃肠道中的稳定性及首过效应对药物口服生物利用度具有显著影响。
本实验通过HPLC法测定GTP的含量,体外考察GTP在不同生理pH以及大鼠胃内容物、胃黏膜、小肠内容物、大肠内容物、肠黏膜、血浆及肝组织匀浆中的稳定性,初步揭示影响GTP稳定性的因素及其在体内的可能代谢部位,为GTP的剂型设计及合理用药提供依据。
材料和方法
试剂
甲醇(色谱纯,TEDIA);超纯水(Millipore Simplicity@水纯化系统,USA);GTP对照品(中国药品生物制品检定所,批号110770-200510);龙胆苦苷原料药(本课题组自制,GTP含量为78.5%);牛血清白蛋白(New England BiolabsInc.,英国);其余试剂均为分析纯。
动物
SD大鼠(本校实验动物中心),雄性,体重(200±20)g,清洁级,许可证号SCXK沪2002-0002。仪器LC-20AB型高效液相色谱仪,SPD-20A紫外检测器(SHIMADZU,Japan);pHS-2C型pH计(上海雷磁仪器厂);DK-S24型恒温水浴锅(上海华联医疗器械有限公司);TJ-25冷冻离心机(Bech-manCoulter,USA);XW-80A型涡旋混合器(上海医科大学仪器厂);JYD-650智能型超声波细胞粉碎机(上海之信仪器有限公司)。
色谱条件
色谱柱:Agela Venusil XBP-C18(5μm,4.6mm×250mm),保护柱:Securityguard C18(5μm,4.0mm×2.0mm);流动相:甲醇-水(30:70);流速:1mL/min,柱温:30℃;进样体积:10μm;检测波长:270nm。
龙胆苦苷的制备
龙胆药材用70%乙醇加热回流提取3次,合并提取液,减压浓缩,回收溶剂。浓缩液加入适量水,离心后得澄清龙胆上柱液。取-定浓度的龙胆上柱液,以合适的流速上大孔吸附树脂柱,吸附完毕后,用3BV(柱体剂)的蒸馏水及6BV20%的乙醇洗脱液以2BV/h流速依次洗脱,收集洗脱液,减压回收溶剂,冷冻干燥即得龙胆总苷原料药。经测定,其中龙胆苦苷含量为78.5%。
GTP在不同pH缓冲液中的稳定性精密称取1.50g的龙胆总苷原料药于100mL容量瓶中,加水溶解并稀释至刻度,摇匀,即得龙胆总苷储备液。取龙胆总苷储备液1mI。于100mL容量瓶中,加入(37±0.5)℃恒温水浴中预热的pH6.8、pH7.4、pH8.0磷酸盐缓冲液及pH1.2盐酸溶液至刻度,摇匀,置于(37±0.5)℃水浴中孵育,于不同时间取样0.5mL,冰浴终止反应,放至室温后,立即取10μm,进行HPLC测定。
GTP在大鼠生物样品中的稳定性
空白生物样品的制备
取SD大鼠禁食不禁水12h以上,乙醚麻醉,经腹腔主动脉取血处死,迅速取出胃、小肠、大肠和肝脏至冰浴中备用。全血经肝素钠抗凝,4℃冷冻离心(5000r/min)15min得空白大鼠血浆。
分别用适量冰冷的pH1.2盐酸溶液、pH6.8及pH8.0磷酸盐缓冲液冲洗大鼠胃、小肠及大肠,收集内容物。分别用冰冷的pH7.4磷酸盐缓冲液将上述胃及小肠洗净,轻柔翻转,使黏膜侧向外,用玻璃片轻轻刮取黏膜,加入冰冷的pH7.4磷酸盐缓冲液,在冰浴中超声制备胃及肠黏膜组织匀浆。
将上述内容物及组织匀浆在4℃冷冻离心(5000r/min)15min取上清液,采用改良Lowry法测定蛋白含量,分别用相应pH溶液调节蛋白质浓度至1.2mg/mL,作为空白生物样品。用注射器吸取冰浴冷却的pH7.4磷酸盐缓冲液,经门静脉注入肝脏,灌流,除去肝中血液。用冰浴冷却的pH7.4磷酸盐缓冲液洗净,滤纸吸干外部水分,剪碎称重后,加入10倍量冰浴冷却的pH7.4磷酸盐缓冲液,冰浴条件下制备组织匀浆。4℃冷冻离心(5000r/min)15min取上清液即得空白大鼠肝组织匀浆。所有空白生物样品临用前新鲜制备,所有实验操作均在4℃以下条件进行。
生物样品处理方法
取生物样品0.2mL,加入0.6mL甲醇,漩涡1min,4℃冷冻离心(8000r/min)10min后,立即取10μm上清进样,外标法定量。
GTP在生物样品中的稳定性试验
取龙胆总苷储备液100弘L于10mL容量瓶中,加入(37±0.5)℃水浴预热的上述空白生物样品稀释至刻度,摇匀,置于(37±0.5)℃的恒温水浴中孵育,于不同时间取样,立即投入冰浴终止反应,平行处理3份。按“生物样品处理方法”项下方法操作,外标法测定含量。
结果
GTP在大鼠生物样品中分析方法的建立
方法专属性考察试验的结果表明,在前述的液相条件下,GTP与各组织的内源性物质分离情况良好,无杂质峰干扰。GTP的保留时间为6.8min,分离效果良好。各生物样品回归方程及相关系数结果见表1:
各生物样品测定的方法回收率均介于94%~105%之间,日内精密度RSD均小于3%,日间精密度RSD均小于4%。
GTP在不同pH溶液中的稳定性
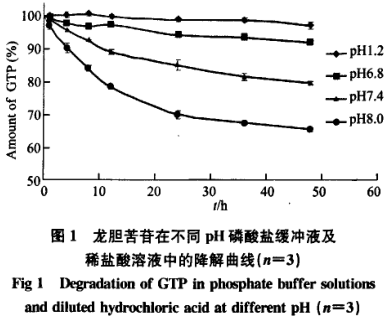
GTP在37℃pH6.8、pH7.4、pH8.0磷酸盐缓冲液及pH1.2盐酸溶液中的降解过程并不表现为-级动力学过程,其降解曲线见图1:
37℃孵育48h后,GTP在pH1.2的盐酸溶液、pH6.8、7.4和8.0的磷酸盐缓冲液分别降解2.6%、7.9%、20.2%和34.4%。pH对GTP降解速率的影响大小次序为:pH8.0>pH’7.4>pH6.8>pH1.2。GTP在偏酸性环境中较稳定,随碱性增强稳定性显著降低。
GTP在大鼠生物样品中的稳定性血浆中的稳定性
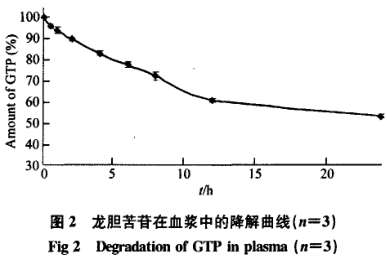
GTP在血浆中的降解曲线如图2所示:
GTP在血浆中的降解较为明显,24h降解46.9%±0.7%,与pH7.4磷酸盐缓冲液中(24h降解14.9%±0.5%)相比,血浆中GTP的降解速率明显加快,提示血浆中可能存在降解GTP的酶。肝组织匀浆中的稳定性GTP在肝组织匀浆中非常稳定,37℃孵育6h后,降解率不超过3%。提示GTP口服给药时,几乎不存在肝首过效应。
胃内容物和胃黏膜中的稳定性
GTP在胃内容物和胃黏膜中非常稳定,37℃孵育6h后,降解率均不超过1%。
肠内容物和肠黏膜中的稳定性
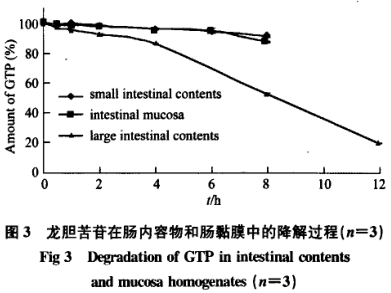
GTP在肠黏膜与小肠内容物中的降解程度相似,37℃孵育8h后,降解率分别为9.1%±0.4o/6和5.0%±0.4%。GTP在大肠内容物中极不稳定,37℃孵育8h后,降解率为47.4%±0.5%,孵育12h后,降解率为79.8%±0.5%。与pH8.0磷酸盐缓冲液中12h降解21.5%±0.6%相比,本研究发现大肠内容物中GTP的降解速率明显加快,提示大肠内酶和菌丛参与了GTP代谢。
GTP在肠内容物和肠黏膜中的降解曲线如图3所示:
讨论
药动学研究发现GTP的口服生物利用度较低。由于GTP水溶性较好,因此其在胃肠道的溶出速度应该不是限制因素,提示其他因素,如GTP在胃肠道中的稳定性、膜通透性和肝首过效应等可能是造成GTP口服生物利用度低的主要原因。
本研究通过考察GTP的体外稳定性,揭示了GTP的主要降解部位和影响因素。药物在体内的降解,受体内pH环境、各种酶及微生物的影响,所以,本研究首先模拟了消化道和血液的pH环境,考察体内pH环境对GTP稳定性的影响。胃液的主要成分是胃酸(盐酸),空腹时胃液的pH值为1~3,饮食后胃液pH值可增至3~5,小肠液的pH值为5~7,大肠pH为7~8,血液的pH值为7.26~7.44。因此,采用盐酸和磷酸盐配制了不同pH的模拟体液。结果发现GTP在偏酸性环境中较稳定,随碱性增强稳定性显著降低。药物在体内的降解,不仅受pH值的影响,还受体内各种酶及微生物的影响。
本研究发现GTP在胃内容物、胃黏膜、小肠内容物、肠黏膜和肝组织匀浆中的降解过程类似于在各自不同pH缓冲液中的降解过程,提示这些部位的药物代谢酶对GTP没有降解作用,GTP在胃、小肠和肝脏部位均较为稳定。
冯怡等研究发现GTP人体静脉滴注给药后主要以原形自肾经尿液排泄,累积尿药排泄率平均为76.1%。大鼠静注GTP2h后。肾排泄量即达给药量的88.2%,24h排泄总量为93.4%,而在粪便中未检测出原形药物,说明GTP在肝脏中几乎不被代谢,提示其口服给药时没有明显的肝首过效应,本研究结果与文献报道相一致。
同时,试验结果显示GTP在大肠内容物中的降解速率明显加快,提示不仅是大肠内的碱性环境会影响GTP的稳定性,大肠内的菌丛和/或酶同时参与GTP代谢,与文献报道的肠内的酶或菌丛对其具有明显的降解作用相一致。GTP首先被肠内菌产生的葡萄糖苷酶水解为苷元(二烯醛),然后经来自肠内菌代谢氨基酸产生的氨生成希夫氏盐,再经环合而生成含氮化合物。
参考文献:略